Après un point de vocabulaire sur les « big pharmas » et les « big biotech », cet article présente les concepts à l’oeuvre dans les thérapies cellulaires et géniques, dont les célèbres (dans le milieu médical) CAR-T et le très couteux Zynteglo.
Le mot « Biotech » est devenu un synonyme de PME de la recherche médicale, par opposition aux « Big Pharmas » qui sont des géants cotés en bourse.
Un petit point vocabulaire pour commencer : à l’origine « Big Pharma » s’entendait pour l’industrie pharmaceutique dans son ensemble, le « Big » évoquant son poids économique et par extension l’efficacité de son lobbying. Aujourd’hui on ne parle plus, en tout cas pas en français, de « Big Pharma » comme d’une seule entité, un genre de léviathan industriel, mais on parle d’une big pharma pour qualifier un laboratoire pharmaceutique de taille mondiale. En anglais on peut utiliser aussi « MNC » pour multinational company. Par extension, on parle parfois de « Big Biotech » pour les plus grosses biotechs comme Biogen, Amgen ou AbbVie. Ce club, et donc la popularité de son nom, est particulièrement restreint car la plupart des biotechs qui ont atteint une taille conséquente ont été rachetées par des Big Pharmas (citons par exemple : Genentech par Roche, Millenium par Takeda, MedImmune par Astrazeneca, Genzyme par Sanofi).
La définition stricto sensu de biotechnologie n’inclut que les médicaments produit par « génie biologique » (concrètement par fermentation, comme la bière…), on devrait donc exclure celles qui développent des petites molécules chimiques. En effet, l’industrie pharmaceutique est historiquement liée à l’industrie de la chimie. C’était une sous-catégorie de la « chimie fine ». Sanofi est par exemple en partie issue de Rhône Poulenc et en partie de Elf Aquitaine. Historiquement, trouver des nouveaux médicaments consistait à synthétiser des nouvelles molécules, éventuellement en s’inspirant de molécules naturelles. L’innovation venait du talent des chimistes pour imaginer et synthétiser ces nouvelles molécules qui étaient testées de manière très ouverte pour vérifier si elles pouvaient avoir une utilité médicale. Aujourd’hui, cette distinction entre chimie et biotechnologie n’a plus vraiment de sens. Toutes les Big Pharmas font de la biotechnologie et des « biotechs » développent des nouvelles molécules chimiques.
On range aussi parfois dans la catégorie « biotech », même si j’ai parfois lu « health tech », les entreprises qui utilisent l’outils Big Data, Intelligence Artificielle et autres domaines informatiques liés à la Data Science pour l’identification de nouveaux médicaments.
De cette grande diversité dans la famille « biotech » découle un grand nombre d’approches possibles, notamment en fonction des outils utilisés, qui seront détaillées dans plusieurs posts différents pour les garder d’une longueur raisonnable. Aujourd’hui nous nous concentrerons sur une partie des thérapies cellulaires et géniques.
Les thérapies cellulaires et géniques.
Le principe est de modifier l’expression d’un (trans)gène dans l’organisme, soit pour réparer des cellules malades en les forçant à produire des protéines initialement manquantes ou non-fonctionnelles, dans le cas des maladies génétiques, ou pour faciliter la mort de cellules cancéreuses, ou encore pour forcer le système immunitaire à s’attaquer à des cellules cancéreuses qu’il ignore habituellement.
On peut en théorie faire toutes les modifications imaginables : éteindre un gène, le rallumer ou faire s’exprimer une version d’un gène introduit artificiellement dans la cellule (on parlera alors d’un transgène). Chez la souris de laboratoire beaucoup de ces interventions ont démontré le potentiel thérapeutique de ces approches. Cependant, chez l’homme, obtenir l’autorisation des agences sanitaire pour des thérapies quelle qu’elles soient impose des contraintes de fabrication, de contrôles et engendre des coûts de « développement » qui ont pour l’instant limité le développement de ces thérapies à quelques grandes approches que nous allons en partie décrire ici.
Toutes ces approches utilisent des vecteurs viraux pour introduire les gènes médicaments dans les cellules.
Les vecteurs viraux : de la compréhension de la biologie des virus à la construction d’outils thérapeutiques.
On peut imaginer que le but premier de la virologie était d’offrir des pistes pour mieux soigner ou prévenir les maladies qu’ils causent mais, comme souvent en science, les applications peuvent sortir du domaine initial. D’aucun dirait que cela plaide en faveur du maintien d’un dialogue soutenue entre les différentes disciplines scientifiques.
Revenons à nos moutons ! La compréhension des différents virus a notamment consisté à décrire leur génome et à comprendre à quoi servaient les différents gènes. En éliminant les gènes causant les signes cliniques et en les remplaçant par des gènes « médicaments », on peut « pirater » ces virus pour exploiter leur capacité à rentrer dans certains tissus et à utiliser les cellules infectées pour produire certaines protéines. La version courte c’est qu’on a identifié que les gamma retrovirus, les lentivirus, les adenovirus, les adeno associated virus avaient des caractéristiques intéressantes pour la thérapie génique et cellulaire.
Chaque type de virus a son propre profil bénéfices/risques pour servir de vecteur aux gènes médicaments. Ces caractéristiques sont notamment la « capacité d’emport » (i.e. la longueur du gène qu’on peut transporter), l’efficacité de l’infection (le nombre de cellules effectivement infectées), les types de tissus qui peuvent être infectés, la ou les phases du cycle cellulaire susceptibles au virus, la facilité à le produire ou encore la capacité à s’intégrer dans le génome du patient. Pour ce dernier point, le fait de s’intégrer dans le génome, une caractéristique des gamma retrovirus et des lentivirus, est un facteur de risque. En effet, en s’insérant au mauvais endroit, ils peuvent activer certains proto-oncogène (des gènes qui déclenchent des cancers) ou tout simplement perturber des gènes indispensables au fonctionnement de la cellule.
De nombreux essais clinique ont eu lieu avec ces différents types de vecteurs. Sur la base de cet expérience accumulée, le travail de génie biologique s’applique maintenant à twister les différents gènes et autres promoteurs des virus afin de maximiser les avantages des vecteurs tout en limitant leurs risques au minimum et en optimisant leur « fabricabilité ».
Il y a deux grands types d’approches : les modifications in vivo et les modifications ex vivo.
Pour la première, on injecte au patient un vecteur viral qui va transporter le gène médicament dans les cellules du patient. Ce gène médicament sera ensuite exprimé par les cellules du patient lui-même.
Pour la seconde, on prélève chez le patient les cellules que l’on souhaite modifier, on réalise la modification au laboratoire (ex vivo donc), à l’aide de vecteurs viraux en règle générale, puis on lui réinjecte les cellules modifiées. A ma connaissance, seules les cellules sanguines et immunitaires sont susceptibles d’être modifiées de cette manière, limitant de facto la couverture thérapeutique possible des thérapies géniques ex vivo. Néanmoins, c’est cette approche qui a pour l’instant donné lieu au plus grand nombre de thérapies approuvées et c’est de celle dont nous allons traiter aujourd’hui.
L’approche in vivo sera traitée dans un prochain post.
Les thérapies qui ont démontré le plus d’efficacité pour l’instant sont les thérapies ex vivo.
La France, par le biais de l’association Généthon, elle-même financée par le Téléthon, a été pionnière dans le domaine avec un premier essai clinique lancé en 1999 pour soigner des jeunes patients avec un syndrome d’immunodéficience sévère (les « bébés bulles ») en modifiant ex vivo leurs cellules immunitaires pour qu’elles expriment la protéine dont l’absence causait la maladie. Cette première historique a démontré la possibilité de traiter certaines maladies génétiques, la plupart des patients ayant été effectivement guéris, mais en a aussi illustré les risques, 4 patients, sur les 9 traités, ont développé des leucémies aiguës déclenchées par l’insertion du gène « médicament » dans une mauvaise zone du génome. Depuis, d’autres thérapies ont été approuvés et les vecteurs viraux transportant les gènes médicaments ont évolués pour limiter les risques de leucémie.
En oncologie, on peut citer les fameux « CAR-T cells » pour « Lymphocytes » (T-cell) « Chimeric Antigen Receptor ». Il s’agit de thérapies contre le cancer dans lesquels on modifie génétiquement des cellules immunitaires pour qu’elles reconnaissent les cellules cancéreuses qu’elles ignorent habituellement. Le récepteur utilisé est dit « chimérique » car ce n’est pas un récepteur naturel mais un récepteur qui active ces lymphocytes en permanence, pour contourner l’inhibition normalement provoquée par l’environnement tumoral (le système immunitaire reconnait en général efficacement les cellules tumorales mais celles-ci sécrètent un ensemble de signaux qui « endorment » les cellules immunitaires les rendant inefficaces). On utilise pour l’instant les propres cellules du patient, ce qui garantit une absence de réaction de rejet mais qui transforme la thérapie en défi logistique. En effet, il faut tout faire en un minimum de temps, au risque que les cellules du patient ne meurent avant d’avoir été réinjectées. La traçabilité des cellules est aussi absolument critique pour ne pas risquer d’injecter les cellules d’un patient à un autre patient, au risque d’une réaction de rejet potentiellement mortelle. Ce délai minimum de 5 à 6 semaines doit aussi suffire à réaliser les contrôles permettant de démontrer l’absence d’activation d’oncogène, comme dans l’essai du Téléthon.
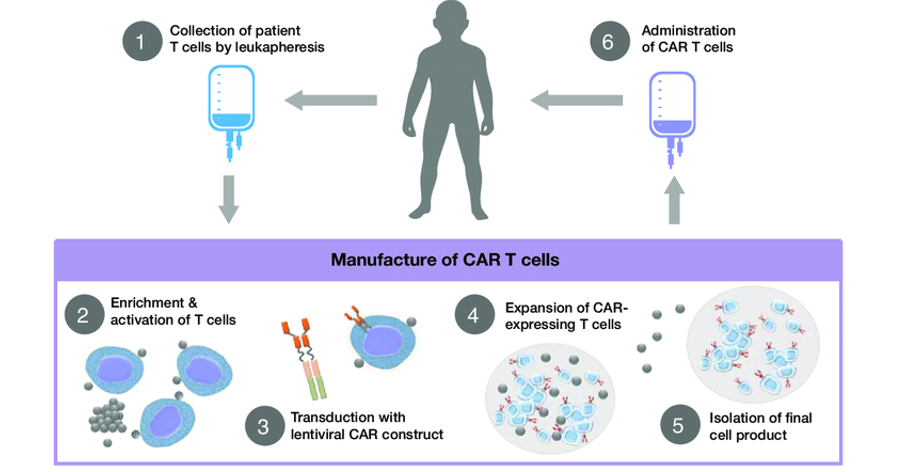
C’est une thérapie très efficace pour un grand nombre de patients. Si je prends l’exemple du Yescarta, pour les patients atteints de lymphome folliculaires, les données cliniques disponibles ont montré que le traitement induisait une réponse chez 91% d’entre-eux, dont 77% de réponse complète (plus aucune cellule tumorale détectable), contre 40% et 15%, respectivement, avec le traitement de référence précédent. Les risques ne sont pas absents, le principal étant le déclenchement d’une « tempête de cytokine » (cytokine release syndrome ou CRS en anglais), potentiellement mortelle, causée par un emballement de la réaction immunitaire, suite à l’arrivée de ces lymphocytes suractivés.
C’est aussi un médicament ultra-coûteux. En France, un pays qui négocie pourtant durement les prix de ses médicaments, Yescarta est remboursé au fabricant à hauteur de 327 000€ par traitement !
La même approche (collecte des cellules du patients, modification génique puis réimplantation) est utilisée par la société bluebird bio pour réinjecter des cellules souches sanguines dont on a corrigé le gène de la béta-globine. Des essais sur un petit nombre de patients laissent espérer que le traitement (Zynteglo) puisse guérir les patients atteints de β-thalassémie et leur permettre de se passer des transfusions régulières qui leur sont aujourd’hui indispensables. Là encore, le prix laisse songeur : 2,8M$…
Des entreprises (Cellectis, Caribou biosciences ou la startup lyonnaise Allogenica, par exemple) essaient d’utiliser des cellules « standards » issues de donneurs pour permettre une fabrication facilitée qui pourraient augmenter le nombre de patients pouvant bénéficier de ces thérapies tout en diminuant considérablement les coûts de fabrication.
Conclusion
A ce jour (3 janvier 2023), seules 13 thérapies cellulaires ou génique, telles que décrites ici, sont approuvées par l’agence sanitaire américaine (la FDA). (ref : https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/approved-cellular-and-gene-therapy-products, les 14 autres listées correspondent principalement à du sang de cordon ombilical, utilisé pour certains types de transfusion).
Le potentiel thérapeutique est immense, notamment pour soigner des pathologies qui n’ont aucun médicament efficace aujourd’hui, et les investissements considérables du secteur biotech/pharma, combinés à l’expérience développée ces 25 dernières années, sont de bons augures de futurs succès thérapeutiques.
